Una de las tácticas de estos microorganismos infecciosos consiste en recubrir sus membranas celulares con una biopelícula densa y pegajosa que actúa como escudo para evitar que entren estos fármacos y los eliminen. Investigadores daneses han encontrado ahora una forma de acabar con esta estrategia.
Prácticas de higiene con iluminación UV en un hospital para evitar infecciones. / Adobe Stock
Las bacterias resistentes a los antibióticos son expertas en desarrollar nuevas estrategias para evitar ser eliminadas por los antibióticos, lo cual ha generado uno de los problemas de salud global más preocupantes. La Organización Mundial de la Salud (OMS) calcula que al año unos 11 millones de personas fallecen por sepsis bacteriana.
Uno de estos microorganismos es la Pseudomonas aeruginosa, que se encuentra de forma natural en el suelo y el agua, pero también en hospitales, residencias de ancianos o centros de atención primaria, donde puede haber personas con sistemas inmunitarios debilitados.
Investigadores de la Universidad del Sur de Dinamarca, liderados por la microbióloga Clare Kirkpatrick, han descubierto ahora un mecanismo que reduce la formación de una densa capa en la superficie de las bacterias. Se trata de una poderosa táctica, a modo de escudo, que desarrollan estos microorganismos para no ser atacados por los antibióticos y que también usa la P. aeruginosa. Los resultados del trabajo se han publicado en la revista Microbiology Spectrum.
Kirkpatric explica a SINC el modo en el que la bacteria forma esta capa protectora: “Detecta que está en contacto con una superficie adecuada, o que hay una alta densidad bacteriana en el entorno, y empieza a fabricar una gran cantidad de material polisacárido de biopelícula y a transportarlo fuera de la célula”.
Luego, “produce una gruesa capa fuera de las células, que mezcla y adhiere firmemente a las bacterias entre sí y a la superficie. La densidad del material ralentiza la difusión de los antibióticos, de modo que solo entran en contacto con las células de manera gradual y a menudo estos fármacos no alcanzan una concentración suficiente como para matarlas”.
En otras palabras, “este biofilm es tan espeso y pegajoso que el antibiótico no logra penetrar ni alcanzar su objetivo en el interior de la célula”, subraya.
Tres genes
Para ver la forma en la que se podría destruir este material con el que se protege la bacteria, los investigadores daneses trabajaron con tres genes recién descubiertos (denominados PA1371-1372, PA2732 y PA2735) en una cepa de P. Aeruginosa cultivada en laboratorio.
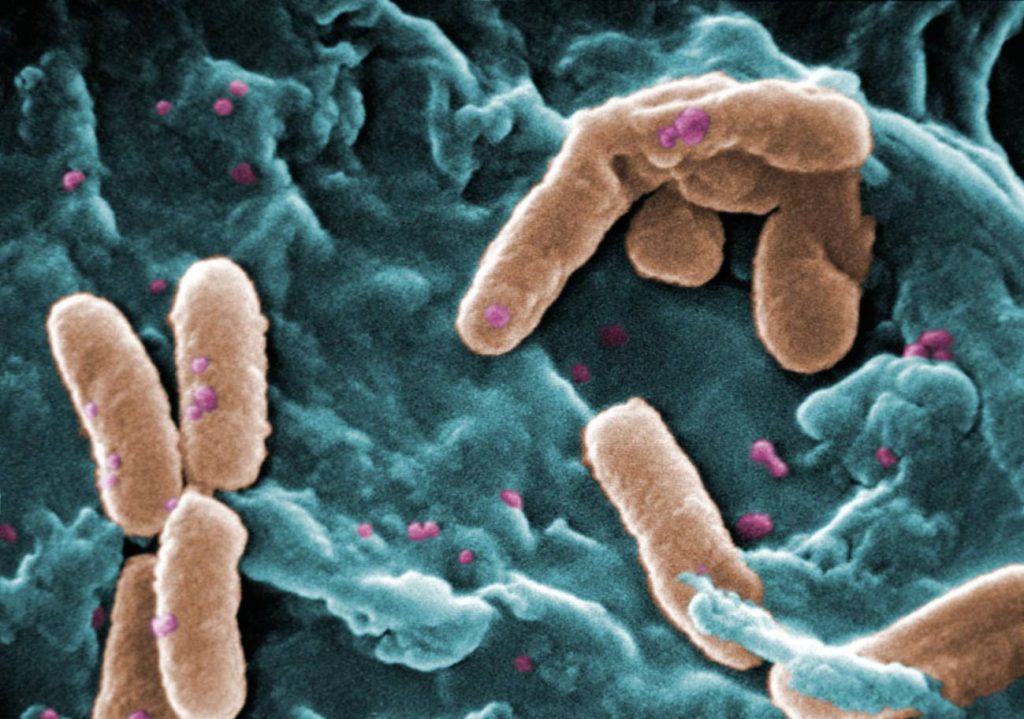 Micrografía electrónica de barrido de la bacteria Pseudomonas aeruginosa. / Janice Haney Carr (CDC) / Wikipedia
Micrografía electrónica de barrido de la bacteria Pseudomonas aeruginosa. / Janice Haney Carr (CDC) / WikipediaCuando aumentaron la expresión de estos genes, observaron una fuerte reducción de la biopelícula. Lo importante es que el sistema afectado por los genes forma parte del genoma central de P. Aeruginosa. Esto significa que se encuentra universalmente en todas las cepas de esta especie bacteriana secuenciadas hasta ahora, dicen los autores.
Kirkpatrick explica que “al formar parte del genoma central de la bacteria, este mecanismo se ha encontrado en todas las variantes investigadas del microorganismo, incluida una gran variedad de cepas aisladas de pacientes. Por lo tanto, hay razones para creer que la reducción de la biopelícula mediante este método podría ser eficaz en todas las cepas conocidas de P. Aeruginosa«.
Las bacterias pueden evolucionar individualmente y mutar de forma rápida y constante cuando están bajo presión. No es raro que los pacientes infectados por una variante de P. Aeruginosa respondan bien inicialmente al tratamiento antibiótico, pero luego se vuelvan resistentes a medida que los microorganismos desarrollan resistencia durante el tratamiento. Las cepas mutan, pero su genoma central común no cambia.
Tensionar la membrana celular
En sus experimentos, los investigadores activaron el sistema reductor de las biopelículas mediante la sobreexpresión de genes. Pero además descubrieron que el mecanismo se estimula de forma natural por el estrés de la pared celular.
“Hemos descubierto también que la tensión de la membrana de las células induce la activación de la expresión de los genes, y que esto reduce de manera natural la capa protectora de las bacterias, aunque todavía no sabemos exactamente cómo”, indica Kirkpatrick.
En el futuro, “nos gustaría buscar métodos farmacológicos para inducir la activación de los genes de forma aún más eficaz, o quizás aumentar la actividad de los productos génicos, para intentar conseguir el mismo efecto.
Según la microbióloga, por el momento, “los fármacos dirigidos a membrana celular no se utilizan de manera rutinaria contra P. Aeruginosa, pero quizá podrían empezar a usarse como aditivos para reducir la producción de biopelícula y mejorar el acceso de los antibióticos a las células».
Tal vez, concluye, “estos aditivos podrían incluirse como ‘antibióticos auxiliares’. Por ejemplo, incorporados a dispositivos médicos o a vendajes, y así resultar útiles por sus propiedades antibiopelícula contra las infecciones por P. aeruginosa. De esta forma, se podría ayudar a los antibióticos ‘de referencia’ a hacer mejor su trabajo en beneficio de los pacientes”.
_____________
Referencia:
Magnus Z. Østergaard, Clare Kirkpatrick: “The uncharacterized PA3040-3042 operon is part of the cell envelope stress response and a tobramycin resistance determinant in a clinical isolate of Pseudomonas aeruginosa. Microbiology Spectrum (2024).
Fuente: SINC






