Este ácido graso hace que el corazón funcione correctamente después del nacimiento
Científicas del Centro Nacional de Investigaciones Cardiovasculares han comprobado en ratones recién nacidos que el ácido gamma linolénico (GLA), aportado por la leche materna, impulsa la maduración metabólica cardiaca. Aunque se desconoce si en humanos ocurre lo mismo, los resultados podrían tener implicaciones terapéuticas en algunas patologías cardiovasculares.
SINC - CEST
Modelo de ácido gamma-linolénico. / SubDural12
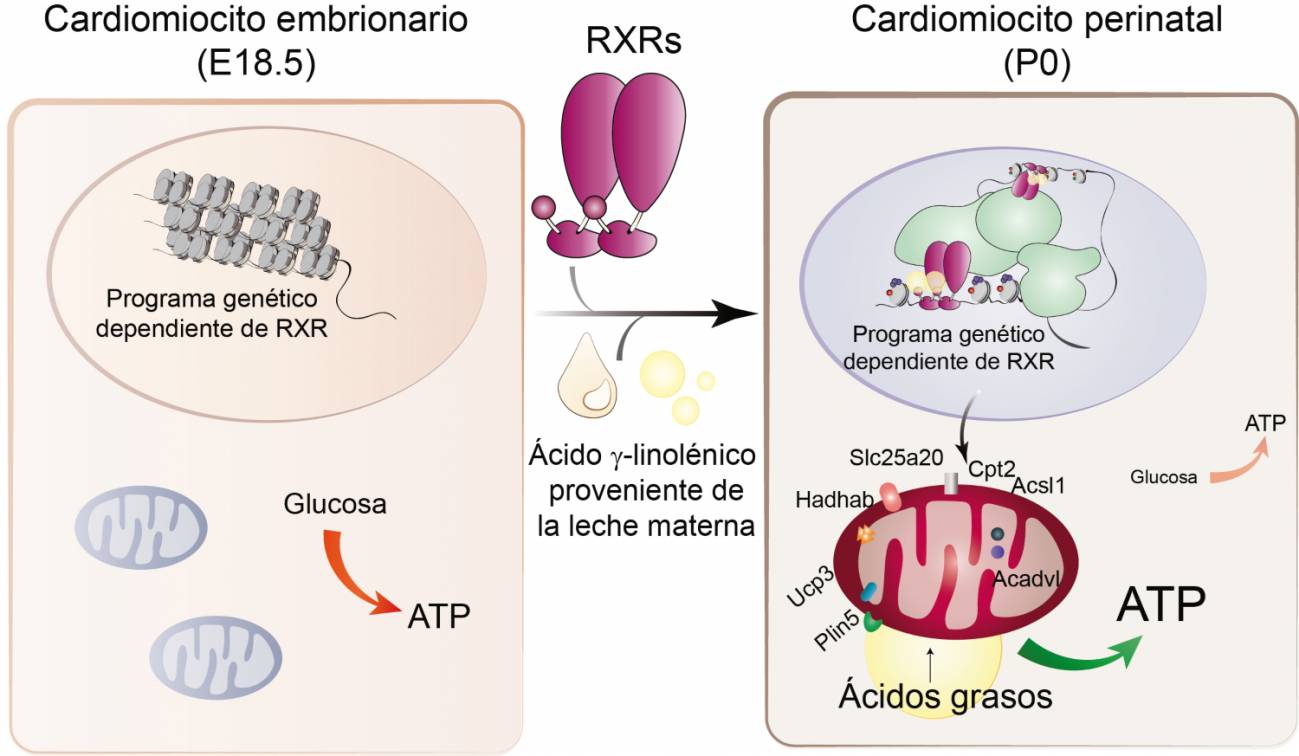
Un estudio liderado por investigadoras del Centro Nacional de Investigaciones Cardiovasculares (CNIC) ha revelado que la ingesta de leche materna es la señal esencial para que el corazón neonatal madure metabólicamente tras el nacimiento, permitiendo que el corazón funcione correctamente y asegurando la supervivencia posnatal.
La ingesta de leche materna es la señal para que el corazón neonatal madure metabólicamente, según este estudio en ratones
En concreto, es el ácido graso omega-6 gamma linolénico (GLA) proveniente de la leche materna, el encargado de unirse a la proteína celular Receptor X de Retinoide (RXR).
RXR es una proteína que actúa como sensor nutricional de lípidos y derivados de la vitamina A, alterando la expresión génica e influyendo funciones biológicas tan importantes como la inmunidad, la diferenciación celular o el metabolismo.
Unión GLA-RXR
Una vez RXR detecta el GLA materno, pone en marcha programas genéticos que equipan a la mitocondria, la central energética de las células, con las proteínas necesarias para comenzar a consumir lípidos, la fuente principal de energía en el corazón maduro.
Los resultados del estudio pueden tener implicaciones terapéuticas en disfunciones mitocondriales y metabólicas
Los resultados, publicados en la revista Nature, podrían tener grandes implicaciones terapéuticas en patologías cardiovasculares donde existan disfunciones mitocondriales y metabólicas, así como enfermedades relacionadas con alteraciones de procesos madurativos tras el nacimiento, asegura Mercedes Ricote, jefa del Grupo de Señalización de los Receptores Nucleares del CNIC y líder del estudio.

De izquierda a derecha: los investigadores del CNIC Vanessa Núñez, Jesús Vázquez, Emilio Camafeita, Ana Paredes, Pablo Hernansanz-Agustín, Mercedes Ricote, Fátima Sánchez Cabo y Fernando Martínez. / CNIC
En la investigación se ha demostrado, en un modelo de ratón, que tanto la ausencia de RXR en el corazón, como la falta del ácido graso omega-6 GLA en la leche materna, impiden que las mitocondrias produzcan energía correctamente, conduciendo a un fallo cardíaco severo que acaba provocando la muerte a las 24-48 horas después del nacimiento.
La falta del ácido GLA en la leche materna o de la proteína RXR en el corazón (con la que se une) impiden que las mitocondrias produzcan energía, conduciendo a un fallo cardíaco
Al nacer, el corazón del bebé debe empezar a producir rápidamente energía para iniciar el latido cardíaco en el ambiente extrauterino. Para ello, los cardiomiocitos, células contráctiles del miocardio, necesitan activar las mitocondrias, orgánulos generadores de ATP (adenosín trifosfato o trifosfato de adenosina) que sustentan las rutas bioenergéticas de la célula. Aunque este proceso es esencial para la supervivencia del organismo, hasta ahora había muy poca información sobre las señales que desencadenan la adaptación fisiológica del corazón tras el parto.
Mantener un latido correcto
“La necesidad de mantener un latido constante e ininterrumpido hace que el corazón requiera altos aportes energéticos”, explica Ricote. “Para cumplir con sus necesidades energéticas, las células cardiacas tienen un control muy estricto de las rutas celulares que producen energía. Sin embargo, cualquier desequilibrio en estos mecanismos bioenergéticos puede conducir a la aparición de patologías cardiovasculares graves”.
Para la investigadora, la novedad de este trabajo “reside también en que es la primera vez que se demuestra que, al contrario de lo que se creía, RXR cumple una función esencial en el músculo cardíaco. Este hallazgo supone un avance conceptual muy importante en el campo científico de los receptores nucleares”.
 Es la primera vez que se demuestra que, al contrario de lo que se creía, la proteína RXR cumple una función esencial en el músculo cardíaco. Mercedes Ricote, investigadora del CNIC
Es la primera vez que se demuestra que, al contrario de lo que se creía, la proteína RXR cumple una función esencial en el músculo cardíaco. Mercedes Ricote, investigadora del CNIC 
El estudio, propone un ángulo muy novedoso para entender las adaptaciones posnatales que se desencadenan para que el organismo cumpla los requisitos en el ambiente extrauterino. “El nacimiento constituye un desafío fisiológico para el recién nacido”, afirma Ana Paredes, autora principal e investigadora del CNIC.
Señal de leche materna a cardiomiocitos
“Con este trabajo demostramos que la ingesta de leche materna, además de su función nutricional, cumple un papel señalizador avisando a los cardiomiocitos de que deben activar su metabolismo, porque ya no les sustenta la fisiología materna”, añade.
Resumen infográfico del estudio / CNIC
Los resultados, subrayan las investigadoras, abren la posibilidad de modular la actividad de RXR en células cardíacas mediante el uso de fármacos específicos, alguno de ellos aprobados por las autoridades sanitarias de EEUU (FDA) para el tratamiento de algunos cánceres. “Nuestro trabajo propone a RXR como una diana terapéutica potencial de las enfermedades cardiacas neonatales, y en patologías sistémicas provocadas por fallos metabólicos”, concluye Ricote.
En cualquier caso, los autores señalan que este estudio se ha centrado únicamente en ratones, y que queda por investigar si el GLA de la leche humana es igualmente esencial para la función cardiaca o la maduración metabólica del recién nacido.
____________
Referencia:
Paredes, A. et al. “g-linolenic acid in maternal milk drives cardiac metabolic maturation” Nature (2023)
En este estudio han colaborado los equipos del CNIC dirigidos por los doctores José Antonio Enríquez, Fátima Sánchez-Cabo y Jesús Vázquez. Además, han intervenido laboratorios nacionales e internacionales: Centro Nacional de Biotecnología y el Centro de Investigaciones Biológicas Margarita Salas, ambos pertenecientes al Consejo Superior de Investigaciones Científicas (CNB-CSIC, CIB-CSIC); Universidad Complutense de Madrid (UCM); Universidad de Barcelona (UB); Instituto de Biología Funcional y Genómica/ Universidad de Salamanca (IBFG/USAL); CEMBIO/CEU San Pablo; CIBER de Enfermedades Cardiovasculares (CIBERCV), y el Instituto Karolinska (Suecia).
_________
Fuente:
CNIC
Derechos: Creative Commons.




