El glaseado que camufla al coronavirus
Una capa de azúcares recubre al patógeno y ayuda a esconderlo de nuestro sistema inmunitario. Ahora, gracias a los superordenadores, podemos verlos por primera vez y pintar una imagen del coronavirus totalmente diferente
La proteína espícula del SARS-CoV-2 'desnuda' (izquierda) y recubierta del glaseado de glicanos (azúcares) que la protegen y la esconden de nuestro sistema inmunitario (derecha).LORENZO CASALINO, ZIED GAIEB; AMARO LAB, UNIVERSIDAD DE CALIFORNIA SAN DIEGO.
FERNANDO GOMOLLÓN-BEL
Los azúcares son las biomoléculas más abundantes del mundo. De hecho, se calcula que representan el 70% del peso de toda la materia viva del planeta. Entre sus múltiples funciones, los glicanos –cadenas de azúcares– son responsables de algo que a menudo se pasa por alto: la comunicación entre células. Casi todas las estructuras biológicas –como las membranas celulares y las proteínas – están recubiertas de una capa de glicanos. Esta capa externa es fundamental para los procesos infecciosos, en los que un agente patógeno interactúa directamente con la superficie de nuestras células. Y el SARS-CoV-2, el virus que causa la covid-19, no es una excepción.
Aproximadamente un 70% de toda la superficie de la proteína espícula está recubierta de glicanos, tal y como demuestra un estudio liderado por Rommie Amaro, de la Universidad de California en San Diego. “Los azúcares escapan a lo que podemos ver bajo el microscopio”, explica Amaro. Existen técnicas, como la microscopía crioelectrónica, capaces de “congelar” las biomoléculas para poder observarlas. “Pero los azúcares se mueven demasiado rápido para poder verlos con esta tecnología”, añade. Por eso, los investigadores decidieron utilizar simulaciones por ordenador para reconstruir el glaseado que recubre a la proteína espícula, y así entender su papel durante la infección.
En el caso del SARS-CoV-2, los azúcares resultan fundamentales por partida doble. En primer lugar, porque estabilizan la espícula en una conformación que le permite encajar con los receptores ACE2 de nuestras células, el proceso que inicia la infección. Amaro y su equipo demuestran que, al eliminar algunos glicanos de la superficie, la proteína espícula se desestabiliza y, además, se debilita la unión con estos receptores. “Es la primera vez que se identifica a un azúcar como parte del proceso de fusión”, dice Elisa Fadda, investigadora en la Universidad de Maynooth, en Irlanda, y co-autora del estudio. Asimismo, este recubrimiento de azúcares también ayuda a camuflar al coronavirus de nuestro sistema inmunitario. “Todas nuestras células están recubiertas de azúcares”, explica Fadda. El coronavirus ha desarrollado un glaseado indistinguible del de nuestras propias células y consigue pasar desapercibido. “Si la proteína pululara por ahí ‘desnuda’, nuestro sistema inmunitario la reconocería inmediatamente como una amenaza. Gracias a los glicanos, el virus no parece un extraño”. Estas nuevas imágenes de la proteína espícula del coronavirus son muy diferentes de las que estamos acostumbrados a ver. En esta imagen se representa la proteína espícula en azul claro, y su recubrimiento de azúcares en azul oscuro (véase imagen superior).
Los resultados del equipo de Amaro dan pistas sobre posibles tratamientos para la covid-19. El recubrimiento es diferente en las diferentes partes de la proteína espícula. La parte superior tiene recubierto el 62% de su superficie, dejando más espacio disponible para tratamientos con moléculas grandes, como los anticuerpos monoclonales, que la parte inferior. Las simulaciones por ordenador también revelan que este “glaseado” es menos eficaz resguardando a la proteína de moléculas pequeñas, que podrían acceder sin problemas a en torno al 80% de la superficie. Descubrir las partes más vulnerables de la espícula puede ayudar a los investigadores a encontrar fármacos más eficaces contra la covid.
El estudio de los glicanos que recubren al coronavirus también es fundamental para el desarrollo de vacunas. Las vacunas de Pfizer-BioNTech, Moderna y AstraZeneca utilizan nuestra propia maquinaria celular para crear copias de la proteína espícula del coronavirus y generar una respuesta inmunitaria sin que tengamos que sufrir la enfermedad. En los últimos meses se han desarrollado técnicas que permiten analizar los diferentes azúcares que envuelven esta proteína “señuelo” generada por las vacunas y compararlos con la espícula real del SARS-CoV-2. A pesar de que en ambos casos son nuestras células quienes fabrican una y otra proteína, sus glaseados son ligeramente diferentes, según algunos estudios preliminares. Esto provoca que, a veces, las vacunas generen señuelos imperfectos que provocan una respuesta inmunitaria más débil. “Las diferencias son mínimas, en ningún caso tan dramáticas como para afectar a la eficacia de las vacunas”, aclara Fadda. “Lo importante es entenderlas, estudiarlas y aprender para el desarrollo de futuras vacunas”, añade. De hecho, ya hay grupos investigando nuevas vacunas diseñadas para evitar estos problemas, y algunas ya están en la última fase de ensayos clínicos.
Todas nuestras células están recubiertas de azúcares. El coronavirus ha desarrollado un glaseado indistinguible del de nuestras propias células y consigue pasar desapercibido
Resulta curioso cómo, desde que se detectaron los primeros casos en Wuhan hace poco más de un año, hemos oído hablar de proteínas, ARN, ADN e incluso lípidos –los componentes de la envoltura del coronavirus que podemos destruir usando agua y jabón–, pero nadie menciona la importancia de los azúcares. “Es bastante común”, explica Carme Rovira, profesora de investigación ICREA en la Universidad de Barcelona. “Se suelen olvidar, incluso cuando se dibujan la célula y sus componentes en los libros de texto”. Y es verdad, las membranas que rodean nuestras células están totalmente cubiertas de azúcares. En 1900, el biólogo austríaco Karl Landsteiner descubrió los grupos sanguíneos, y gracias a esto en 1907 se realizó la primera transfusión de sangre exitosa. Sin embargo, se tardó varias décadas en descubrir que nuestros glóbulos rojos están recubiertos de cadenas de azúcares características de los grupos A, B, AB y O. “Estos glicanos son como códigos de barras, nuestras células pueden leerlos para identificarse entre ellas, y también detectar amenazas, como bacterias y virus patógenos” explica Rovira. Por eso, al recibir una transfusión de alguien con un grupo sanguíneo distinto pueden provocarse reacciones inmunitarias adversas.
El funcionamiento de una de nuestras mejores armas contra la gripe, el antiviral Tamiflu (oseltamivir), también está relacionado con la química de los azúcares. Los virus de la gripe utilizan una proteína de su envoltura, la neuraminidasa, para detectar un azúcar del “glaseado” de nuestras células –el ácido siálico– y entrar en nuestras células, promoviendo la infección. “La estructura química del Tamiflu es muy similar al ácido siálico, por lo que engaña a las proteínas del virus de la gripe, las bloquea y reduce el avance de la enfermedad”, añade Rovira. Entender bien la estructura, la posición y el comportamiento de los azúcares es clave para el diseño de vacunas y medicamentos eficaces, tanto para la covid-19 como para otras enfermedades. “Las células cancerosas, por ejemplo, presentan un recubrimiento de azúcares muy denso, incluyendo algunos que las camuflan de nuestro sistema inmunitario”. Muchos investigadores buscan formas de destruir este escudo, para desenmascarar a las células tumorales y hacerlas más susceptibles ante nuestras células inmunitarias.
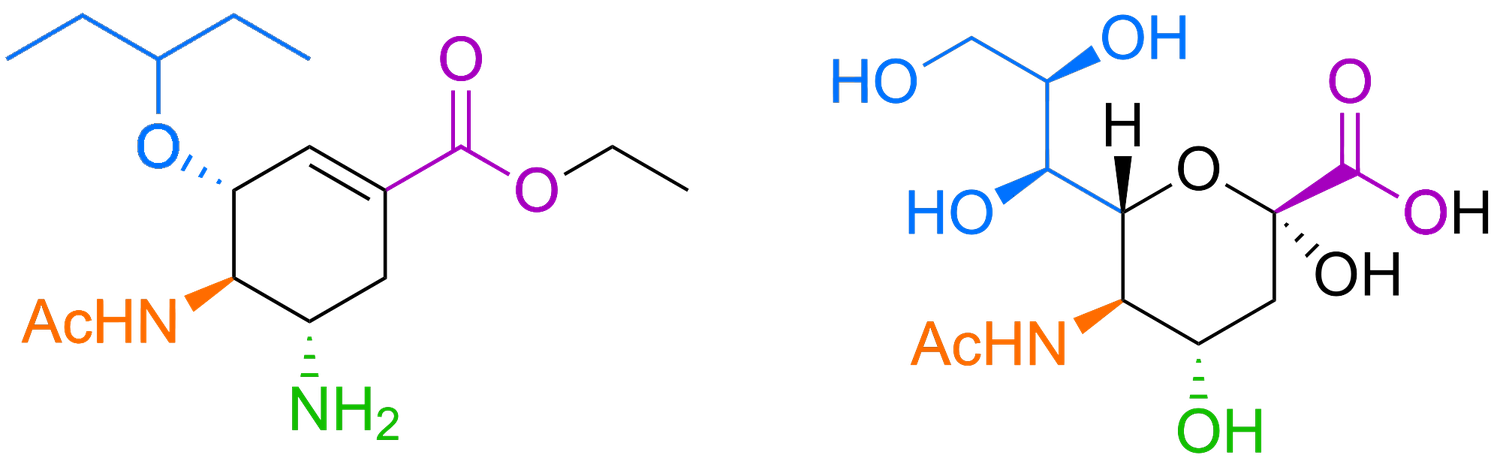
Estructura química del antiviral Tamiflu (izquierda), utilizado contra el virus de la gripe, y el ácido siálico, un azúcar que forma parte del recubrimiento de glicanos de nuestras células (derecha).FERNANDO GOMOLLÓN BEL.
Rovira también utiliza los métodos computacionales para entender los mecanismos moleculares de enzimas que se encargan de “decorar” nuestras células con glicanos – formando el glaseado –, y el pasado noviembre recibió, junto con investigadores de la Universidad de Leiden y la Universidad de York, más de nueve millones de euros del Consejo Europeo de Investigación (ERC) para investigarlas. Los estudios por ordenador son fundamentales, el trabajo sobre el glaseado de la proteína espícula “habría sido prácticamente imposible hace diez años” – dice Rovira. El equipo de Amaro y Fadda necesitó casi dos meses de simulaciones en uno de los superordenadores más potentes del mundo: Frontera, en Texas. También utilizaron las instalaciones facilitadas por PRACE, la alianza europea de computación avanzada –a la que pertenece el Centro Nacional de Supercomputación–, que ya a finales de marzo lanzó una convocatoria para financiar investigación que ayudara a mitigar el impacto de la pandemia.
Tras décadas estudiando el genoma y el proteoma, ha llegado el turno del “glicoma” – el conjunto de estructuras formadas por azúcares distribuidos por nuestras células. Por su estructura química, los azúcares pueden formar cadenas mucho más variadas que el ADN o las proteínas. “Pero también son estructuras mucho más complejas, nos queda muchísimo por descubrir para poder descifrar todas sus funciones”, concluye Rovira.
____________
Fuente:






